비알콜성 지방간염(NASH)란 무엇? 치료제 개발현황은?
2020년7월12일 신영증권 이명선님 레포트와 몇가지 내용 추가
비알콜성 지방간염(NASH)은 무엇인가?
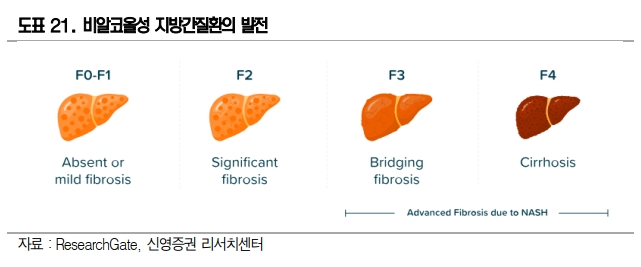
비알코올성 지방간(Non-alcoholic fatty liver disease, NAFLD)은 흔한 질환이고 특별한 증상이 없다보니 많은 사람들이 진단을 받고도 대수롭지 않게 넘어간다. 그러나 간에 지방만 많은 단순 지방간(F0/F1)의 20%가 염증까지 동반된 NASH로 진행한다.
즉, NASH는 지방축적과 함께 간세포 손상, 그리고 염증이 동반된 상태를 말하며 간섬유화, 간경변증, 간세포암종을 초래된다.
NASH은 아직 치료제가 없으며, 조직생검 외에는 뚜렷한 바이오마커가 없어 진단이 어렵다. 초기 NASH는 섬유화가 일어나게 되면서(F2/F3)는 점차 간경화(F4)로 발전하고 발병 1년 후 환자 생존률이 약 43%에 불과하다.
NASH치료제 시장은 2026년 기준 USD 25bil(글로벌데이터)으로 전망하는데 그 중 미충족 수요가 많은 단계는 F3와 F4로 이러한 시장은 NASH 전체 시장의 20~25%에 해당할 것이다.
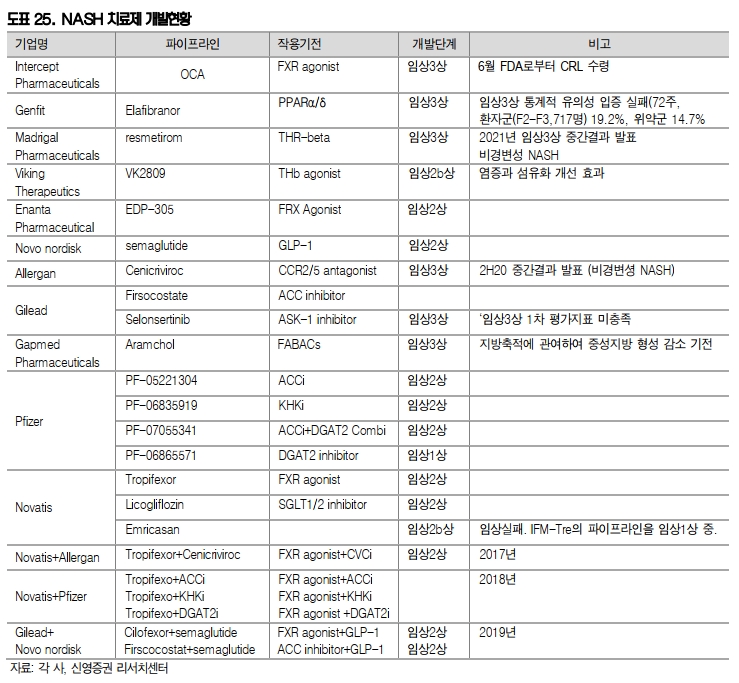
인터셉트 오칼리바의 FDA 판매승인 실패
지난 6월 24일 첫번째 비알코올성 지방간염(Non-alcoholic steatohepatitis,NASH)으로 허가 받을 것이라 예상했던 인터셉트(Intecept)의 오칼리바(Ocaliva, obeticholic acid)가 FDA로부터 CRL를 받고 판매승인에 실패하였다.
임상 3상 REGENERATE에서 환자의 NASH가 악화되지 않고 환자의 간섬유증에 대해 1단계 개선을 달성하였으나 섬유화 없이 NASH 해소(resolution)은 달성하지 못하였다. 그리고 부작용으로 가려움증 및 간, 쓸개 내 부작용이 있었다.
일부 환자들 중 나쁜 콜레스테롤이 증가했고, 그로 인해 심혈관계 위험도가 높아졌다. 많은 NASH 환자들이 이미 과체중이거나 제 2형 당뇨병을 갖고 있다는 점을 감안할 때, 이는 허가의 부정적인 요소가 될 수 있다.
종합적으로 볼 때 약물의 유익성, 약물의 잠재적 위해성이 불확실하므로, FDA는 인터셉트에게 오칼리바의 안전성과 장기적 효능 데이터를 추가로 제출하라고 지시했다.
작년 11월 FDA로부터 혁신치료제 지정받고 우선심사를 결정하여 4월 22일로 정해졌던 심사기한을 한차례 연장하였고, 3월에는 코로나19 사태로 회의일정이 6월 9일로 변경하였지만 결국 FDA 허가 불발로 결과 발표당일 주가가 40% 하락하였다.
FDA의 NASH치료제 개발 가이드라인
FDA는 2018년 12월 섬유증이 있는 비경변성 비알콜성 지방간염, 2019년 6월 보상성 간경변이 있는 비알콜성 지방간염(compensated cirrhosis with NASH)에 대한 치료제 개발에 대한 가이드라인을 발표하였다.
가이드라인에 따르면, 임상의 주요 평가지표는 지방간염, NASH 해소(resolution) 또는 간섬유화 지수 1단계 이상 개선이다.
역시 중요한건 질병이 낫는 것이다.
젠핏 엘라피브라노 임상3상 결과
젠핏(Genfit)의 경우, 지난 2월 엘라피브라노(Elafibranor)에 대한 임상 3상(RESOLVE-IT)이 실패해 임상시험 중단을 결정했다. 젠핏은 2~3단계 섬유증을 가진 NASH 환자 1,070명을 대상으로 72주 간의 치료 후 위약과 엘라피브라노 120mg를 분석하였다.
그 결과, 엘라피브라노 군(717명)에서 반응률은 19.2%인 반면, 위약군 환자에서는 14.7%였다. 섬유화 개선에 있어서도 위약 군은 22.4%, 엘라피브라노는 24.5%만 개선되어 1단계 이상의 개선에는 통계적으로 유의하지 않았다.
젠핏은 임상 중간 효능 데이터를 검토한 결과 미국과 유럽에서 엘라피브라노 승인 가능성이 낮아 임상을 중단키로 결정했다. 이 회사는 이번 결정은 새로운 기업 전략의 첫 단계로 비용을 절감하고 원발성담즙성간경변(PBC)에 대한 엘라피브라노의 개발과 NASH 진단을 위한 NIS4 프로그램의 상업적 성장에 집중할 방침이라고 설명했다.
회사 측은 PBC 시장이 2035년까지 15억 달러 규모가 될 것으로 예상되고 충족되지 않은 영역으로 ‘흥미로운 기회’가 될 것이라고 밝혔다.
엘라피브라노는 PBC에 대한 임상 2상에서 유망한 결과를 보여 미국 FDA로부터 혁신 치료제(Breakthrough Therapy) 지정을 받고 임상 3상을 준비하고 있는 상태다.
노보노디스크 임상2상
노보노디스크의 경우, 제2형 당뇨병 치료제로 주1회 투여 주사제 오젬빅(Ozempic)과 경구용 리벨서스(Rebelsus), 그리고 비만치료제로 판매승인 받은 삭센다 성분인 semaglutide(GLP-1)을 NASH에 접목하였다.
임상 2상에서 가장 높은 용량인 0.4mg에서 72주간 치료한 섬유화 단계 F2`~F3인 환자의 59%(33/56)가 증상이 개선되었다. 그리고 0.1mg에서는 40%, 0.2mg에서는 36% 증상이 개선되었다. 반면 대조군은 17%(17/58)이였다. 장기간 사용하여도 부작용없이 효과가 나타나다 보니 유사 기전으로 NASH를 접근하는 한미약품의 임상결과에 기대감이 높아진다.
NASH 치료제 병용투여
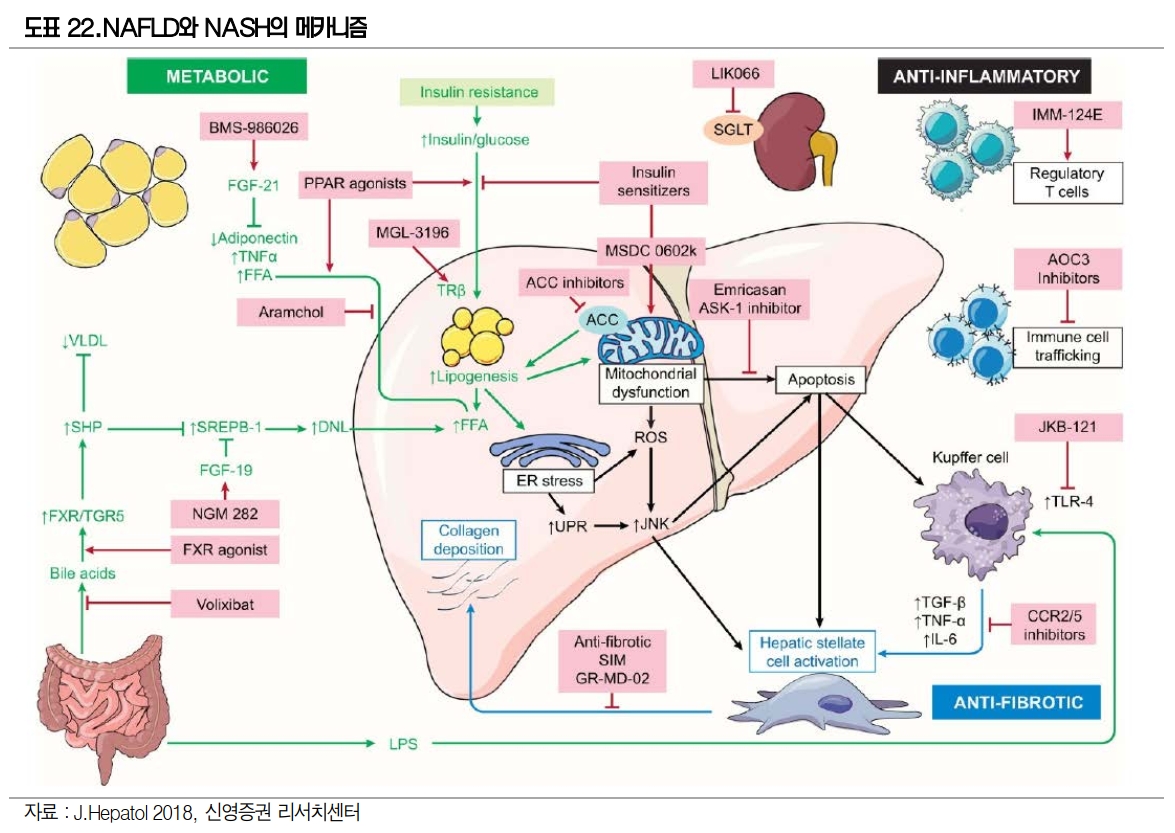
최근 NASH 치료제 개발을 병용투여로 진행하고 있다. NASH 발생 및 진행은 인슐린 저항성, Lipitoxicity, Oxidative stress, 면역작용 이상, apoptosis, mitochondrial dysfunction 등 다양한 요인으로 인한다.
그리고 최근 Intercep의 OCA(FXR agonist), Genfit의 Elafibranor(PPARα/δ ), 길리어드의 Selonsertinib(ASK-1 inhibitor) 등 서로 다른 기전을 보유한 약물들이 임상 3상을 진행하였으나 임상실패 또는 허가실패를 경험하였다.
이에 면역항암제의 병용요법처럼 긍정적인 작용기전을 가진 두 가지 이상 약물 투여하는 병용치료 연구도 진행되고 있다. 노바티스가 Emricasan에 대한 임상 2상을 실패한 이후 2017년 앨러간과, 2018년 화이자과 공동연구를 진행하였다.
그리고 2019년에는 길리어드가 노보노디스크가 함께 병용투여 임상을 진행하고 있어 임상결과에 대한 기대감이 높다.
참고로 국내에서는 작년 1월 유한양행이 길리어드와 얀센에 기술수출을 하였고, 한미약품의 LAPS-Tri Agonist와 엔지켐생명과학의 EC-18이 NASH로 개발하고 있다. 특히 한미약품의 경우 미국 임상 1상을 통해 안전성과 간지방량 감소와 간섬유화 증상 개선에 대한 효과 결과가 발표되고 있어 파이프라인 기대감이 높다.